造血干细胞(Hematopoietic Stem Cell,HSCs)的损伤耗竭与白血病干细胞(Leukemia Stem Cells,LSCs)的治疗耐药性是重大血液系统疾病治疗困难的主要原因。因此,解析HSC和LSC稳态维持的异同,开发靶向LSCs的清除策略具有重要的研究意义。近日,血液领域国际著名期刊Leukemia在线发表了暨南大学衰老与再生医学研究院鞠振宇研究员,陈陟阳研究员,暨南大学附属第一医院郭军教授团队,以共同作者在Leukemia在线发表了题为Ferritin-Mediated Mitochondrial Iron Homeostasis is essential for the Survival of Hematopoietic Stem Cells and Leukemic Stem Cells的研究论文,该研究揭示了载铁蛋白Fth1介导的线粒体铁稳态在调控HSC和 LSCs功能中的重要作用,并提出基于LSCs铁代谢靶向治疗急性髓系白血病的新思路。

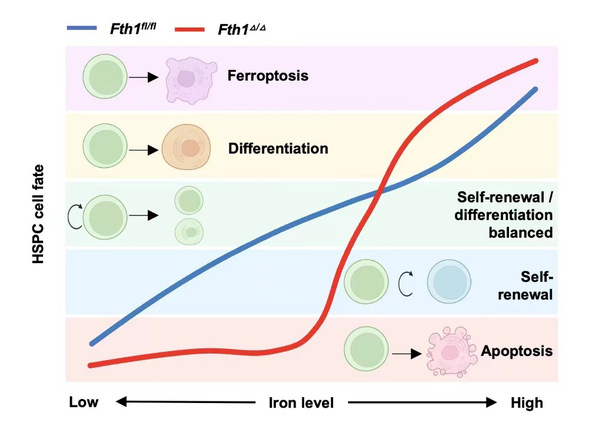
铁在细胞中参与线粒体电子传递,DNA合成,关键酶行使功能等众多作用,细胞中的铁代谢受到严格调控,过多游离铁通过芬顿反应诱导氧化应激以及铁死亡,铁含量降低抑制线粒体功能,导致铁依赖的酶促反应异常。载铁蛋白由重链(Fth1)和轻链(Ftl1)两种亚基组成,将胞质中的游离铁以Fe3+形式储存起来,在生理病理情况下对细胞维持铁的动态变化平衡至关重要。白血病等血液疾病往往伴随着铁代谢的异常,然而,铁代谢调控HSC及LSC的机制尚不明确。
应用血液系统特异性基因缺失小鼠模型,研究发现Fth1基因的缺失导致小鼠HSC中铁含量降低,数目减少,髓系偏向分化,最终导致HSC造血重建能力下降。机制研究发现,Fth1缺失不依赖铁死亡,而是通过诱导HSC线粒体功能紊乱促进了HSC的凋亡。补铁,抑制线粒体ROS水平,以及应用凋亡抑制剂可以挽救Fth1缺失导致的HSC活性下降和功能异常。
值得注意的是,Fth1表达与急性髓系白血病病人预后情况呈负相关,应用MLL-AF9-GFP小鼠急性髓系白血病(Acute myeloid leukemia,AML)模型发现,Fth1的缺失可以显著的延长AML小鼠的寿命。进一步的探索发现,LSCs中Fth1的表达量低于HSC,提示LSCs因为载铁蛋白量表达低,进而对细胞铁含量的动态变化具有较差的缓冲和代偿能力。应用铁螯合剂(Deferoxamine,DFO)发现,较低浓度的DFO可以有效地促进LSCs的凋亡,而不影响HSC的活性。补充铁,应用抗氧化剂、凋亡抑制剂,以及小分子促进Fth1表达均可以抵消DFO诱导的LSCs凋亡。
本研究揭示了载铁蛋白介导的线粒体铁含量稳态对维持HSC和LSC功能和细胞活性的重要作用,并指出LSC异常的载铁蛋白表达为通过干预铁代谢靶向清除LSC提供了潜在的治疗策略。
暨南大学衰老与再生医学研究院鞠振宇研究员,陈陟阳研究员,暨南大学附属第一医院郭军教授为共同通讯作者。暨南大学附属第一医院博士后易微微,博士研究生张锦华,暨南大学生科院硕士研究生黄颖欣为本文的共同第一作者,该工作得到了王福俤教授,程辉研究员的大力支持和帮助,并受到国家重大研究计划(培育项目),国家自然科学基金等基金的资助。
原文链接:https://www.nature.com/articles/s41375-024-02169-y
